Propriétés, structure, utilisations et risques de l'iodoate de potassium
Le iodate de potassium ou iodate de potassium est un composé inorganique de l'iode, spécifiquement un sel, dont la formule chimique est KIO3. L'iode, un élément du groupe halogène (F, Cl, Br, I, As), dans ce sel a un nombre d'oxydation de +5; à cause de cela, c'est un oxydant puissant. Le KIO3 se dissocie en milieu aqueux pour créer les ions K+ et IO3-.
Il est synthétisé en faisant réagir de l'hydroxyde de potassium avec de l'acide iodique: HIO3(aq) + KOH (s) => KIO3(aq) + H2O (l) En outre, il peut être synthétisé en faisant réagir de l'iode moléculaire avec de l'hydroxyde de potassium: 3I2(s) + 6KOH (s) => KIO3(aq) + 5KI (aq) + 3H2O (l)

Index
- 1 propriétés physiques et chimiques
- 1.1 Agent oxydant
- 2 structure chimique
- 3 Utilisations et applications de l'iodate de potassium
- 3.1 Usage thérapeutique
- 3.2 Utilisation dans l'industrie
- 3.3 Utilisation analytique
- 3.4 Utilisation dans la technologie des lasers
- 4 Risques pour la santé de l'iodate de potassium
- 5 références
Propriétés physiques et chimiques
C'est un solide blanc inodore, avec de fins cristaux et une structure cristalline de type monoclinique. Il a une densité de 3,98 g / mL, un poids moléculaire de 214 g / mol et des bandes d'absorption dans le spectre infrarouge (IR).
Il a un point de fusion de 833 ºK (560 ºC), compatible avec les fortes interactions ioniques entre les ions K+ et IO3-. À des températures plus élevées, il subit une réaction de décomposition thermique en libérant de l'oxygène moléculaire et de l'iodure de potassium:
2KIO3(s) => 2KI (s) + 3O2g)
Il a solubilités dans l'eau allant de 4,74g / 100 ml à 0 ° C, à 32,3 g / 100 ml à 100 ° C, générant des solutions aqueuses incolores. De plus, il est insoluble dans l'alcool et l'acide nitrique, mais soluble dans l'acide sulfurique dilué.
Son affinité pour l'eau n'est pas appréciable, ce qui explique pourquoi il n'est pas hygroscopique et n'existe pas sous forme de sels hydratés (KIO)3· H2O).
Agent oxydant
L'iodate de potassium, indiqué par sa formule chimique, possède trois atomes d'oxygène. C'est un élément fortement électronégatif qui, en raison de cette propriété, "découvre" une déficience électronique dans le nuage entourant l'iode.
Cette carence, ou entrée, en tant que la casse peut être calculée comme le nombre d'oxydation de l'iode (± 1, 2, 3, 5, 7), qui est 5 dans le cas de ce sel.
Qu'est ce que ça signifie? Que devant une espèce capable de céder ses électrons, l’iode les acceptera sous leur forme ionique (IO3-) pour devenir de l'iode moléculaire et avoir un nombre d'oxydation égal à 0.
Après cette explication, on peut déterminer que l'iodate de potassium est un composé oxydant qui réagit fortement avec les agents réducteurs dans de nombreuses réactions d'oxydo-réduction; Parmi celles-ci, l'une est connue sous le nom d'horloge iodée.
L'horloge iodée consiste en un processus redox consistant en des étapes lentes et rapides, dans lesquelles les étapes rapides sont marquées par une solution KIO.3 dans l'acide sulfurique auquel de l'amidon est ajouté. Ensuite, l'amidon - une fois produit et ancré entre ses espèces de structure I3-- transformera la solution incolore en bleu foncé.
IO3− + 3 HSO3− → je− + 3 HSO4−
OI3− + 5 je− + 6 h+ → 3 I2 + 3 H2O
Je2 + HSO3− + H2O → 2 I− + HSO4− + 2 h+ (bleu foncé par effet d'amidon)
Structure chimique
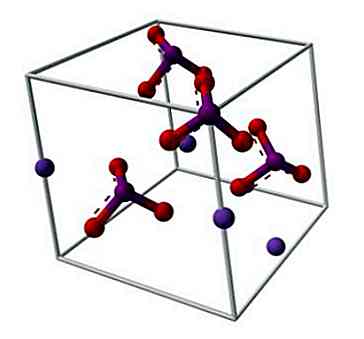
La structure chimique de l'iodate de potassium est illustrée dans l'image supérieure. L'anion IO3- est représenté par le "trépied" des sphères rouges et violettes, tandis que les ions K+ ils sont représentés par les sphères violettes.
Mais que signifient ces trépieds? Les formes géométriques correctes de ces anions sont en fait des pyramides trigonal, dans lequel les atomes d'oxygène forment la base triangulaire, et la paire d'électrons non partagée points d'iode vers le haut, en occupant l'espace et forçant rabattre le lien IO et les deux liens I = O.
Cette géométrie moléculaire correspond à une hybridation sp3 de l'atome d'iode central; cependant, une autre perspective suggère que l'un des atomes d'oxygène forme des liaisons avec les orbitales "d" de l'iode, étant en fait une hybridation sp3d2 (l'iode peut avoir ses orbitales "d" en expansion de sa couche de valence).
Les cristaux de ce sel peuvent subir des transitions de phase structurelles (autres arrangements que le monoclinique) en raison des différentes conditions physiques qui les soumettent.
Utilisations et applications de l'iodate de potassium
Usage thérapeutique
L’iodate de potassium est généralement utilisé pour prévenir l’accumulation de radioactivité dans la thyroïde sous forme de 131I, lorsque cet isotope est utilisé pour déterminer l'absorption d'iode par la thyroïde en tant que composante du fonctionnement de la glande thyroïde.
De même, l'iodate de potassium est utilisé comme antiseptique topique (0,5%) dans les infections des muqueuses.
Utiliser dans l'industrie
Il est ajouté à la nourriture des animaux de la ferme en tant que supplément d'iode. Par conséquent, dans l'industrie, l'iodate de potassium est utilisé pour améliorer la qualité des farines.
Utilisation analytique
En chimie analytique, grâce à sa stabilité, il est utilisé comme standard primaire dans la standardisation des solutions étalons de thiosulfate de sodium (Na2S2O3), dans le but de déterminer les concentrations d'iode dans les problèmes d'échantillons.
Cela signifie que les quantités d'iode peuvent être connues par des techniques volumétriques (titrages). Dans cette réaction, l’iodate de potassium oxyde rapidement les ions iodure I-, au moyen de l'équation chimique suivante:
OI3- + 5I- + 6h+ => 3I2 + 3h2O
Iode, je2, est intitulé avec la solution de Na2S2O3 pour sa standardisation.
Utilisation dans la technologie des lasers
Des études ont démontré et corroboré les propriétés piézoélectriques, pyroélectriques, électro-optiques, ferroélectriques et l’optique non linéaire des cristaux KIO.3. Cela se traduit par un grand potentiel dans le domaine électronique et dans la technologie des lasers pour les matériaux fabriqués avec ce composé.
Risques sanitaires de l'iodate de potassium
À fortes doses, peut causer une irritation de la muqueuse buccale, de la peau, des yeux et des voies respiratoires.
Des expériences sur la toxicité de l'iodate de potassium chez l'animal ont montré que chez le chien à jeun, à la dose de 0,2-0,25 g / kg de poids corporel administré par voie orale, le composé provoque des vomissements.
Si ces vomissements sont évités, cela provoque une aggravation de la situation chez les animaux, car elle provoque une anorexie et une prostration avant la mort. Ses autopsies ont permis d'observer des lésions nécrotiques dans le foie, les reins et la muqueuse intestinale.
En raison de son pouvoir oxydant, il représente un risque d'incendie lorsqu'il entre en contact avec des matériaux inflammables.
Références
- Day, R. et Underwood, A. Chimie analytique quantitative (cinquième édition). PEARSON Prentice Hall, p-364.
- Muth, D. (2008). Lasers. [Figure]. Extrait de: flickr.com
- ChemicalBook. (2017). Iodate de potassium. Extrait le 25 mars 2018 de ChemicalBook: chemicalbook.com
- PubChem. (2018). Iodate de Potassium. Extrait le 25 mars 2018 de PubChem: pubchem.ncbi.nlm.nih.gov
- Merck. (2018). Iodate de potassium. Récupéré le 25 mars 2018 auprès de Merck:
- merckmillipore.com
- Wikipedia. (2017). Iodate de potassium. Récupéré le 25 mars 2018 sur Wikipedia: en.wikipedia.org
- M Abdel Kader et al. (2013). Mécanisme de transport de charge et transitions de phase à basse température dans KIO3. J. Phys.: Conf Sér 423 012036


