Structure, propriétés et utilisations de l'hydroxyde de chrome
Le hydroxyde de chrome est un composé inorganique produit de la réaction d'une base avec un sel de chrome. Sa formule chimique varie en fonction de l'état d'oxydation du chrome (+2 ou +3 pour ce type de composé). Ayant ainsi Cr (OH)2 pour l'hydroxyde de chrome (II) et Cr (OH)3 pour l'hydroxyde de chrome (III).
Pour des raisons électroniques, le Cr2+ il est plus instable que Cr3+, donc le Cr (OH)2 c'est un réducteur (il perd un électron pour passer à +3). Ainsi, bien que les deux hydroxydes puissent être obtenus sous forme de précipités, Cr (OH)3 - également appelé hydroxyde chromique - est le composé prédominant.

Contrairement aux hydroxydes obtenus par la simple dissolution d’oxydes métalliques dans l’eau, Cr (OH)3 il n'est pas synthétisé par cette voie en raison de la faible solubilité de l'oxyde chromique (Cr2O3, image supérieure). Cependant, Cr (OH)3 Il est considéré comme le Cr2O3· XH2Ou, utilisé comme pigment vert émeraude (vert Guinet).
En laboratoire, partie du chrome métallique, qui est dissoute dans une solution acide pour la formation du complexe [Cr (OH2)6]3+. Ce complexe aqueux réagit alors avec une base (NaOH ou KOH) pour former l'hydroxyde chromique correspondant.
Si les étapes précédentes sont effectuées dans des conditions garantissant l'absence d'oxygène, la réaction provient de Cr (OH)2 (hydroxyde de chrome). Par la suite, une séparation et une déshydratation du solide précipité sont nécessaires. En conséquence, "true" (OH) est "né"3, une poudre verte à structure polymérique et incertaine.
Index
- 1 structure
- 1.1 L'octaèdre et la polymérisation
- 2 propriétés physiques et chimiques
- 2.1 Amphotéricisme
- 3 Synthèse de l'hydroxyde de chrome dans le domaine industriel
- 4 utilisations
- 5 références
Structure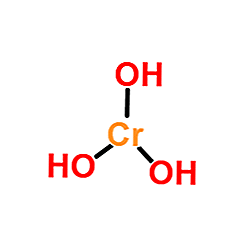
L'image supérieure est la représentation la plus simple de Cr (OH)3 en phase gazeuse et isolé. De même et en supposant le caractère purement ionique de leurs interactions, dans les solides, les cations peuvent être visualisés3+ interagir avec une quantité triplée d'anions OH-.
Cependant, la nature de la liaison Cr-OH est plus covalente, en raison de la chimie de coordination du Cr3+.
Par exemple, le complexe [Cr (OH2)6]3+ indique que le centre métallique du chrome est coordonné avec six molécules d'eau; Comme ils sont neutres, le complexe présente la charge positive du cation d'origine, Cr3+.
L'octaèdre et la polymérisation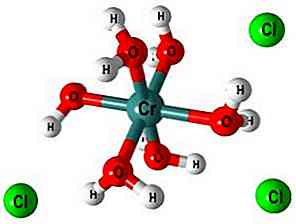
Dans l'image supérieure, la structure du complexe [Cr (OH2)6]3+. Cl ions- ils peuvent provenir, par exemple, de l'acide chlorhydrique s'il a été utilisé pour la dissolution du sel ou de l'oxyde chromique.
Lorsque NaOH (ou KOH) est ajouté au milieu réactionnel, l'ion OH- déprotoner une molécule de ce complexe, formant [Cr (OH2)5(OH)]2+ (Maintenant, il y a cinq molécules d'eau car la sixième a perdu un proton).
Consécutivement, ce nouveau complexe déshydrate un autre complexe aqueux, créant des dimères liés par des ponts hydroxyde:
(H2O)5Cr-OH-Cr (OH2)5
À mesure que la basicité du milieu augmente (le pH augmente), le complexe se forme [Cr (OH2)4(OH)2]+, et augmentent également la probabilité de nouveaux ponts hydroxyde pour créer des polymères gélatineux. En fait, cette "gelée gris-vert" refuse de se précipiter.
Enfin, le Cr (OH2)3(OH)3 se compose d'un octaèdre avec le Cr3+ au centre, et lié à trois molécules d'eau et trois OH- qui neutralise sa charge positive; ceci sans considérer la polymérisation.
Quand le Cr (OH)2)3(OH)3 il se déshydrate, l'eau coordonnée avec le Cr est éliminée3+et comme ce cation est coordonné avec six espèces (ligands), il se forme des structures polymères dans lesquelles des liaisons Cr-Cr peuvent être impliquées.
Aussi, déshydraté, sa structure peut être considérée comme type Cr2O3· 3H2O; en d'autres termes, l'oxyde chromique tri-hydraté. Cependant, ce sont les études physico-chimiques du solide qui peuvent éclairer la véritable structure du Cr (OH)3 à ce stade.
Propriétés physiques et chimiques
Le Cr (OH)3 Il a l'apparence d'une poudre bleu-vert, mais lorsqu'il entre en contact avec l'eau, il forme un précipité gélatineux gris-vert.
Il est insoluble dans l'eau, mais soluble dans les acides et les bases fortes. De plus, lorsqu'il est chauffé, il se décompose en produisant des vapeurs d'oxyde de chrome.
Anfoterismo
Pourquoi l'hydroxyde de chrome est-il soluble dans les solutions acides et basiques? La raison en est sa nature amphotère, qui lui permet de réagir avec les acides et les bases. Cette propriété est caractéristique de Cr3+.
Lors de la réaction avec les acides, Cr (OH2)3(OH)3 il se dissout parce que les ponts hydroxyles se décomposent, responsables de l'aspect gélatineux du précipité.
En revanche, lorsque plus de base est ajoutée, le OH- ils continuent à remplacer les molécules d'eau, formant le complexe négatif [Cr (OH2)2(OH)4]-. Ce complexe fait de la solution une couleur vert clair qui s'intensifie au fur et à mesure de la réaction.
Quand tout le Cr (OH2)3(OH)3 Une fois qu'il a réagi, un complexe final est obtenu comme indiqué par l'équation chimique:
Cr (OH2)3(OH)3 + 3 OH- <=> [Cr (OH)6] 3- + 3 H2O
Ce complexe négatif est associé aux cations environnants (Na+, si la base est NaOH), et après l'évaporation de l'eau, le sel de chromite de sodium précipite (NaCrO2vert émeraude). Ainsi, le milieu acide et le milieu basique sont capables de dissoudre l'hydroxyde de chrome.
Synthèse d'hydroxyde de chrome dans le domaine industriel
Dans l'industrie, il est produit par la précipitation du sulfate de chrome avec des solutions d'hydroxyde de sodium ou d'hydroxyde d'ammonium. De même, l'hydroxyde de chrome est produit par la réaction schématisée:
Cro72- + 3 SO2 + 2h+ => 2 Cr3+ + 3 SO42- + H2O
Cr3+ + 3OH- => Cr (OH)3
Comme indiqué dans la procédure précédente, la réduction du chrome VI en chrome III a une grande importance écologique.
Le chrome III est relativement inoffensif pour le biote, alors que le chrome VI est toxique et cancérigène, en plus d'être très soluble. Il est donc important de l'éliminer de l'environnement.
La technologie de traitement des eaux usées et des sols comprend une réduction du Cr (VI) en Cr (III).
Utilise
- Formulation de maquillages.
- Les colorants capillaires.
- Les peintures pour les ongles.
- produits de soins de la peau.
- Produits de nettoyage.
- Dans la finition des métaux, qui représente 73% de sa consommation dans l’industrie.
- Dans la conservation du bois.
Références
- Whitten, Davis, Peck & Stanley. Chimie (8ème éd.). CENGAGE Learning, p 873, 874.
- PubChem. (2018). Hydroxyde de chrome. Récupéré le 18 avril 2018 de: pubchem.ncbi.nlm.nih.gov
- N4TR! UMbr. (22 juin 2015). Hydroxyde de chrome (III). [Figure] Récupéré le 18 avril 2018 de: commons.wikimedia.org
- Martínez Troya, D., Martín-Pérez, J.J. Etude pour l'utilisation expérimentale des oxydes et des hydroxydes de chrome dans les classes moyennes. BORAX nº 2 (1) -Examen de chimie pratique pour secondaire et Bachillerato-IES. Zaframagón-ISSN 2529-9581.
- Synthèse, caractérisation et stabilité des hydroxydes de Cr (III) et de Fe (III). (2014) Papassiopi, N., Vaxevanidou, K., Christou, C., Karagianni, E. et Antipas, G. J. Hazard Mater. 264: 490-497.
- PrebChem. (9 février 2016). Préparation d'hydroxyde de chrome (III). Récupéré le 18 avril 2018 de: prepchem.com
- Wikipedia. (2018). Hydroxyde de chrome (III). Récupéré le 18 avril 2018 de: en.wikipedia.org




