Hybridation du carbone dans ce qu'il constitue, les types et leurs caractéristiques
Le hybridation carbone implique la combinaison de deux orbitales atomiques pures pour former une nouvelle orbitale moléculaire "hybride" avec ses propres caractéristiques. La notion d’orbite atomique donne une meilleure explication que le concept précédent d’orbite, pour établir une approximation de la plus grande probabilité de trouver un électron dans un atome.
En d'autres termes, une orbitale atomique est la représentation de la mécanique quantique pour donner une idée de la position d'une paire d'électrons ou d'électrons dans une zone donnée à l'intérieur de l'atome, dans lequel chaque orbital est définie en fonction des valeurs de leurs numéros quantique

Les nombres quantiques décrivent l'état d'un système (par exemple d'électrons dans l'atome) à un moment donné, par l'énergie appartenant à électrons (n), le moment cinétique décrit dans son mouvement (L), le moment magnétique associé (m) et le spin de l'électron en se déplaçant à l'intérieur du ou des atomes.
Ces paramètres sont uniques à chaque électron dans une orbite, donc pas de deux électrons peuvent avoir exactement les mêmes valeurs des quatre nombres quantiques et chaque orbitale peut être occupé par deux électrons au maximum.
Index
- 1 Qu'est-ce que l'hybridation du carbone?
- 2 types principaux
- 2.1 Hybridation Sp3
- 2.2 Hybridation sp2
- 2.3 Hybridation sp
- 3 références
Quelle est l'hybridation du carbone?
Pour décrire l'hybridation du carbone, il faut tenir compte du fait que les caractéristiques de chaque orbitale (sa forme, son énergie, sa taille, etc.) dépendent de la configuration électronique de chaque atome.
C'est-à-dire que les caractéristiques de chaque orbitale dépendent de la disposition des électrons dans chaque "couche" ou niveau: du plus proche au noyau à la plus extérieure, également appelée coquille de valence.
Les électrons du niveau le plus externe sont les seuls disponibles pour former un lien. Par conséquent, lors de la génération, ce qui est étroitement liée à la géométrie des molécules est constituée d'une liaison chimique entre deux atomes de chevauchement ou de superposition de deux orbital (une de chaque atome).
Comme indiqué précédemment, chaque orbital peut être rempli avec un maximum de deux électrons, mais le principe Aufbau être suivi, de sorte que les orbitales sont remplis en fonction de leur niveau d'énergie (du plus bas au plus haut), en tant que montre ci-dessous:

De cette façon, le niveau 1 est rempli en premierspuis 2s, suivi de 2p et ainsi de suite, en fonction du nombre d'électrons de l'atome ou de l'ion.
Ainsi, l'hybridation est un phénomène correspondant aux molécules, chaque atome ne pouvant fournir que des orbitales atomiques pures (s, p, d, f) et, en raison de la combinaison de deux orbitales atomiques ou plus, le même nombre d’orbites hybrides permettant les liaisons entre les éléments est formé.
Principaux types
Les orbitales atomiques ont des formes et des orientations spatiales différentes, dont la complexité augmente, comme indiqué ci-dessous:

On observe qu’il n’existe qu’un seul type d’orbite s (forme sphérique), trois types d’orbite p (forme lobulaire, où chaque lobe est orienté sur un axe spatial), cinq types d’orbite d et sept types d’orbite f, où chaque type d’orbite a exactement la même énergie que son type.
L'atome de carbone dans son état fondamental a six électrons, dont la configuration est 1s22s22p2. C'est-à-dire qu'ils devraient occuper le niveau 1s (deux électrons), le 2s (deux électrons) et partiellement 2p (les deux électrons restants) selon le principe Aufbau.
Cela signifie que l'atome de carbone n'a que deux électrons non appariés dans l'orbitale 2p, mais il n'est pas possible d'expliquer la formation ou la géométrie de la molécule de méthane (CH4) ou d'autres plus complexes.
Donc, pour former ces liens, il faut l'hybridation des orbitales s et p (dans le cas du carbone), pour générer de nouvelles orbitales hybrides qui expliquent même les liaisons doubles et triples, où les électrons acquièrent la configuration la plus stable pour la formation de molécules.
Hybridation sp3
Hybridation sp3 consiste en la formation de quatre orbitales "hybrides" à partir des orbitales 2s, 2px, 2pet et 2pz pur
Ainsi, nous avons le réarrangement des électrons dans le niveau 2, où il y a quatre électrons disponibles pour la formation de quatre liaisons et ils sont ordonnés en parallèle pour avoir une énergie inférieure (plus grande stabilité).
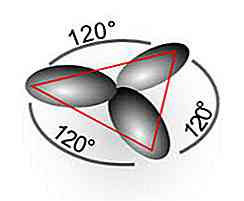
Un exemple est la molécule d'éthylène (C2H4), dont les liens forment des angles de 120 ° entre les atomes et fournissent une géométrie trigonale plate.
Dans ce cas, de simples liaisons C-H et C-C sont générées (à cause des orbitales) sp2) et une double liaison C-C (due à l’orbitale p), pour former la molécule la plus stable.

Hybridation sp2
Par hybridation sp2 trois orbitales "hybrides" sont générées à partir de l'orbitale 2s pure et de trois orbitales 2p pures. De plus, on obtient une orbitale p pure qui participe à la formation d'une double liaison (appelée pi: "π").
Un exemple est la molécule d'éthylène (C2H4), dont les liens forment des angles de 120 ° entre les atomes et fournissent une géométrie trigonale plate. Dans ce cas, de simples liaisons C-H et C-C sont générées (en raison d'orbitales sp).2) et une double liaison C-C (due à l'orbitale p), pour former la molécule la plus stable.
 Hybridation sp
Hybridation sp
Par hybridation sp, deux orbitales "hybrides" sont établies à partir de l'orbitale 2s pure et de trois orbitales 2p pures. De cette façon, deux orbitales p pures sont formées et participent à la formation d'une triple liaison.
Pour ce type d'hybridation, la molécule d'acétylène (C) est présentée à titre d'exemple2H2), dont les liens forment des angles de 180 ° entre les atomes et fournissent une géométrie linéaire.
Pour cette structure, il existe des liaisons simples C-H et C-C (dues aux orbitales sp) et une triple liaison C-C (c'est-à-dire deux liaisons pi dues aux orbitales p) pour obtenir une configuration avec moins de répulsion électronique.

Références
- Hybridation orbitale. Récupéré de en.wikipedia.org
- Fox, M. A. et Whitesell, J. K. (2004). Chimie Organique Récupéré de books.google.co.ve
- Carey, F. A. et Sundberg, R. J. (2000). Chimie organique avancée: Partie A: Structure et mécanismes. Récupéré de books.google.co.ve
- Anslyn, E. V. et Dougherty, D. A. (2006). Chimie organique physique moderne. Récupéré de books.google.co.ve
- Mathur, R. B. Singh, B. P. et Pande, S. (2016). Nanomatériaux de carbone: synthèse, structure, propriétés et applications. Récupéré de books.google.co.ve



 Hybridation sp
Hybridation sp